А. Биохимия
Если выводы Мэри Гиббс о фазах памяти (см. рис. 10.1) были верны, то следовало ожидать, что в первые минуты или часы после клевания горькой бусины в левых, а возможно, и в правых IMHV и LPO будет происходить ряд клеточных изменений, связанных с этими фазами. Поскольку в следующих абзацах речь пойдет о чистой биохимии и я не вижу способа избежать этого, читатель, который не переносит всех этих подробностей, может найти обобщенную схему описываемых процессов на рис. 10.3, а потом перепрыгнуть сразу на страницу 34. Но биохимия — мой хлеб, и я искренне надеюсь, что все эти детали заслуживают хотя бы беглого знакомства с ними.
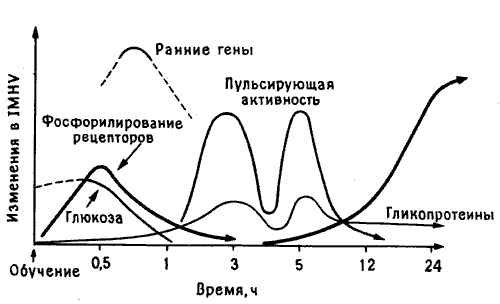
Рис. 10.3. Молекулярный каскад памяти. Кривые схематически показывают последовательность молекулярных изменений, наблюдаемых в IMHV цыпленка в разные сроки после опыта с горькой бусиной.
Мы еще раньше обнаружили кратковременное повышение активности мускариновых рецепторов ацетилхолина. Если бы я работал, как полагается, систематически, то я должен был бы вернуться назад и подробно выяснить, что происходит с этими и другими рецепторами в IMHV. Но я сделал это лишь спустя несколько лет и показал тогда, что сильнее всего изменялось содержание NMDA-рецепторов для глутамата, о которых я говорил в предыдущей главе (и не буду касаться их снова). Но сначала мое внимание привлекли полученные на гиппокампе данные о роли фосфорилированных белков в синаптических мембранах (см. гл. 9). Я не мог устоять перед искушением изучить их у цыплят, может быть потому, что много лет назад моя собственная диссертация была посвящена этим белкам, хотя тогда я не осознавал в полной мере их значение (см. гл. 3).
Пре- и постсинаптические мембраны можно выделить из IMHV методом центрифугирования, примерно так, как описано в главе 3, и исследовать их в чистом виде. Разумеется, они содержат и белки, и фосфорилирующий их фермент протеинкиназу С. Если к ничтожному количеству мембранного материала добавить радиоактивный АТФ и несколько минут инкубировать полученную смесь в крошечной пробирке, мембранные белки окажутся мечеными и фосфорилированными. Другой простой, но остроумный метод позволяет выделить отдельные белки и измерить количество радиоактивной метки в каждом из них. В этом методе используются различия в молекулярном весе и электрических свойствах между сотнями присутствующих в мембранах белков, каждый из которых несет на себе специфический набор положительных и отрицательных зарядов. Для того чтобы разделить такие белки, берут небольшую прямоугольную полоску из студенистого инертного материала — крахмального или акриламидного геля, наносят на один ее конец каплю раствора с белковой смесью и пропускают через гель электрический ток. Белки перемещаются под действием тока с разной скоростью, зависящей от их молекулярного веса и электрического заряда, и через несколько часов распределяются по всей длине полоски. Эта процедура называется, гель-электрофорезом. Гель пропитывают красителем, который окрашивает белки, и они становятся видны на бесцветном фоне геля как последовательность синих полос, похожих на линии, проведенные чернилами. Участки геля, содержащие разные белки, вырезают бритвенным лезвием и определяют их радиоактивность, или же весь гель накладывают на рентгеновскую пленку и получают радиоавтограф, точно так же как в опытах с 2-дГ[31].
В итоге получается то, что представлено на рис. 10.4.
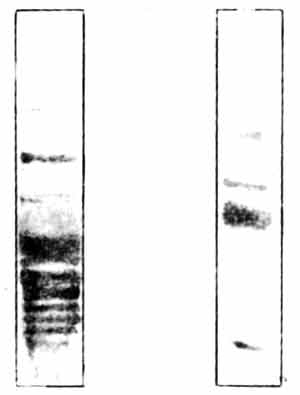
Рис. 10.4. Белки синаптических мембран. На рисунке показаны два геля. Пробы синаптических мембранных белков наносили на верхние концы гелей и в течение нескольких часов подвергали электрофорезу. При этой процедуре тысячи различных белков с разной скоростью мигрируют вдоль геля. Гель слева обработан красителем, выявляющим белки. Обратите внимание на множество полос, каждая из которых представляет один или большее число мигрирующих белков. Справа показан гель, в котором методом радиавтографии установлена локализация продуктов фосфорилирования белков левого геля. Из множества белков фосфорилированию подверглись лишь около четырех. Наиболее интенсивно окрашенная полоса в средней части геля — белок В50 с мол. массой около 50 000; это специфический пресинаптический белок, и именно он изменяется в результате обучения.
Мы измеряли фосфорилирование белков в синаптических мембранах из мозга цыплят в разные сроки после обучения и установили, что спустя 30 минут после клевания горькой бусины усиливалось фосфорилирование одного из ключевых пресинаптических белков. Это изменение не было долговременным и через три часа после обучения уже исчезало. Спустя полчаса после обучения возрастала также активность протеинкиназы С в мембранах левого IMHV [110].
Таким образом, при обучении происходило временное изменение фосфорилирования какого-то пресинаптического мембранного белка, регулируемое ферментом протеинкиназой. Но это было всего лишь преходящим сдвигом: если он и необходим для формирования долговременной памяти, его все же нельзя считать ее единственной биохимической основой. Необходимо какое-то более продолжительное событие, способное вызвать длительную перестройку синапсов. Именно для такой перестройки может понадобиться синтез новых белков.
Биосинтез белков определяется информацией, заключенной в ДНК, т. е. в генах клеточного ядра. Для образования новых белков необходимо, чтобы активировалась ДНК и нужные гены включились в работу. Поэтому изменение фосфорилирования синаптической мембраны, по-видимому приводящее к поступлению в клетку кальция, должно служить своего рода сигналом для ядерной ДНК. Сейчас мы не знаем всех деталей работы этого механизма, но к концу восьмидесятых годов стало ясно, что поступление такого сигнала в ядро активирует группу «генов раннего действия». Этот феномен впервые наблюдали в быстро делящихся раковых клетках, но вскоре была показана его универсальная природа. «Ранние» гены обеспечивают активацию других («поздних») генов и выработку в клеточном ядре инструкций для последующего синтеза ключевых структурных белков — тех, что в конце концов включаются в состав синаптической мембраны, изменяя ее строение. Структурные белки кодируются поздними генами, тогда как ранние гены ответственны лишь за образование группы промежуточных сигнальных пептидов, получивших такие варварские наименования, как c-fos и c-jun. Эти и другие подобные им пептиды воздействуют на ядерную ДНК, включая в работу надлежащие поздние гены. Этот сложный каскад сигналов схематически представлен на рис. 10.5.
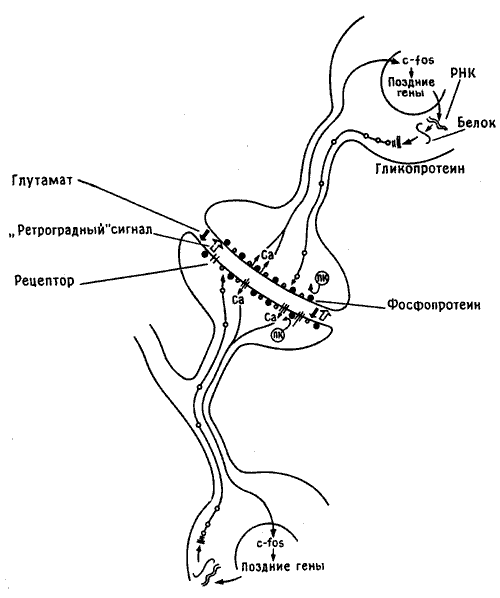
Рис. 10.5. Сигналы между синапсом и ядром. На рисунке изображен синапс на шипике дендрита (разумеется, без соблюдения масштаба), а также тела пресинаптического и постсинаптического нейронов. В процесе формирования памяти нейромедиатор (глутамат, показан черной стрелкой) освобождается из пресинаптического участка и взаимодействует с рецептором на постсинаптической клетке, что приводит к фосфорилированию мембранных белков (черные кружочки) протеинкиназой С (ПК) и поступлению внутрь клетки ионов кальция (Са). Кальций служит сигналом для ядра, где начинается синтез «ранних» (c-fos) и «поздних» генов, которые через РНК кодируют синтез белковых и гликопротеиновых молекул (белые кружочки), а те в свою очередь транспортируются к мембране и включаются в нее, изменяя ее форму и размеры. Параллельно аналогичный процесс запускается под действием ретроградного сигнала (светлая стрелка) в пресинаптической клетке).
Наиболее интересны структурные белки, ибо именно они непосредственно изменяют клетку, а ранние гены и механизм их действия относятся уже к молекулярио-биологическому «подсобному хозяйству», которое представляется таинственным не только большинству людей, далеких от биохимии, но и самим биохимикам. Пептиды c-fos и c-jun тоже представляют интерес, но не просто потому, что служат одним из связующих звеньев между ранними процессами в клеточной мембране и синтезом структурных белков, а потому, что становятся активными только в клетках, претерпевающих пластические изменения; их содержание и локализацию внутри клеток можно с высокой точностью определять с помощью той или иной разновидности радиоавтографического метода, описанного выше. Когда в 1989 году мы начали исследовать роль этого механизма в выработке пассивного избегания, в литературе по молекулярной нейробиологии уже высказывалось немало соображений о том, как можно было бы выявить специфическую активацию c-fos и с-jun при образовании следов памяти. Никто, однако, не поставил ключевого решающего эксперимента.
Я не молекулярный биолог, и мне никогда не пришло бы в голову осваивать методы, необходимые для оценки активности ранних генов, если бы к нам в лабораторию не приехал вдруг из Москвы молодой специалист в этой области Костя Анохин (внук ученика Павлова, психолога и физиолога Петра Анохина, чью «теорию функциональных систем» я упоминал в главе 9). В распоряжении Кости были специфические «зонды», используемые в таких методах, и он проявлял большую тягу к экспериментальной работе. В течение нескольких недель после его приезда мы показали, что через полчаса после обучения (т. е. примерно в то же время, когда изменялось фосфорилирование мембранных белков) в клетках IMHV резко возрастало образование пептидов c-fos и c-jun. Таким образом, мы обнаружили жизненно важный этап на пути от синапса к ядру [11]. Если не считать этих сложностей, вся остальная биохимическая часть работы сравнительно проста. В одной из моих первых серий экспериментов на модели пассивного избегания (после того как я закончил работу с Мэри и еще не установил, что изменения происходят в IMHV и LPO) я исследовал влияние обучения на общий белковый синтез с использованием метода предшественников, описанного в одной из предыдущих глав. Спустя 30 минут после обучения и на протяжении последующих суток я наблюдал усиление синтеза белков в областях мозга, включавших и IMHV. Этот результат согласовался с известным амнестическим эффектом ингибиторов белкового синтеза. Однако я полагал, что значительная часть этого синтеза могла быть связана с образованием новых синапсов или модификацией старых, поэтому нужно было исследовать не белки вообще, а белки синаптических мембран.
Многие из самых важных и характерных белков синаптических мембран относятся к классу гликопротеинов, которые можно описать как молекулы, состоящие из двух частей: длинной цепи аминокислот, погруженной в клеточную мембрану, и еще одной цепочки из молекул сахаров (например, глюкозы, фукозы и галактозы), выступающей из мембран во внеклеточное пространство. Цепочки сахаров «липкие»: когда одна из них находит подходящую цепочку, выступающую над мембраной соседней клетки, они «узнают» друг друга и соединяются. Таким образом, гликопротеины служат узнающими молекулами, и я полагал, что если синапсы — специфические места узнавания и соединения клеток — действительно изменяются при обучении, то гликопротеины должны играть в этом не последнюю роль. Эксперимент, которым я был занят, когда начал писать эту книгу, и о котором рассказал в главе 2, как раз и проводился с использованием фукозы — одного из предшественников гликопротеинов.
Еще в 1980 году мы показали, что наряду с включением аминокислот в белки в первые сутки после обучения усиливается и включение фукозы в гликопротеины пре- и постсинаптических мембран. Сложность состояла в том, что гликопротеины чрезвычайно трудно поддаются анализу и, кроме того, в этих мембранах существует множество различных типов гликопротеинов. В последнее десятилетие мы потратили очень много времени на трудоемкие и зачастую весьма неблагодарные попытки идентифицировать эти белковые соединения (мы пытались даже получить специфические антитела, способные их узнавать). Все, что я на данный момент знаю, во всяком случае все, о чем стоит упомянуть, — это то, что в пре- и постсинаптических мембранах имеется целый ряд гликопротеинов разного молекулярного веса, участвующих в формировании у цыплят реакции на бусину [12].
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОК