Открытие периодического закона
Открытие периодического закона
«Основы химии» издавались отдельными выпусками. Первый из них вышел в июне 1868 года. Он был посвящен общим вопросам химии, а также рассматривал свойства водорода, кислорода и азота. При составлении плана дальнейшей работы у Менделеева возник важный вопрос: в какой последовательности располагать материал? Решение этой проблемы ученый считал не менее важным, чем само изложение сведений. Он писал: «Одно собрание фактов, даже и очень обширное, одно накопление их, даже и бескорыстное, даже и знание общепринятых начал не дадут еще метода обладания наукою, и они не дадут еще ручательства за дальнейшие успехи и ни даже права на имя науки в высшем смысле этого слова. Здание науки требует не только материала, но и плана. При том пока нет плана — нет и возможности узнать многое из того, что уже было кому-либо известно, что уже сложено. Многие факты химии, не нанесенные на ее планы, часто открывались не раз, а два, три и более раз <.>.
В лабиринте известных фактов легко потеряться без плана, и самый план уже известного иногда стоит такого труда изучения, доли которого не стоит изучение многих отдельных фактов».
Сначала Менделеев планировал классифицировать элементы по валентностям, но затем решил располагать их по атомному весу и сходству свойств. В конце 1868 года он закончил работу по составлению дальнейшего плана «Основ химии» и в начале 1869 года приступил ко второй части книги. Но систематизация химических знаний продолжала интересовать ученого с дидактической точки зрения, а классификация элементов — с научной. И размышления над этой проблемой дали в конце концов свой результат. Утром 17 февраля Менделеев получил письмо от своего коллеги профессора Ходнева. На обороте письма Дмитрий Иванович сделал запись, в которой сопоставил по величине атомного веса щелочные и щелочноземельные металлы.
Насколько верно утверждение о том, что решение проблемы Менделеев нашел во сне — неизвестно. Но, по всей видимости, некий момент озарения, во сне или наяву, присутствовал. Иначе трудно объяснить, почему ученый стал развивать такую важную идею на первом листе, попавшемся под руку. Однако, озарение озарением, но дальнейшее исследование Менделеев провел с привычной для него методичностью. Используя карточки, на которых были кратко изложены свойства элементов и указан их атомный век, Менделеев создал вариант таблицы, в которой нашли свое место практически все известные на тот момент элементы. Переписав систему начисто, Менделеев отправил ее в типографию под заглавием «Опыт системы элементов, основанной на их атомном весе и химическом сходстве». Экземпляры «Опыта системы» он разослал своим отечественным и зарубежным коллегам. Вот как выглядела эта система, или, если хотите, первая таблица Менделеева:
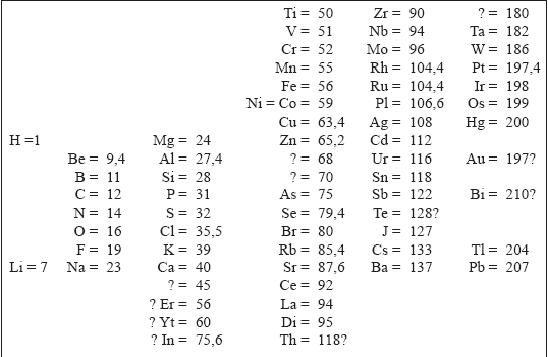
На первый взгляд, эта таблица мало напоминает современный вариант. Но изучив ее внимательнее, можно увидеть, что в ней видны многие закономерности, на которых основана современная система элементов. Так можно заметить, что в «Опыте системы» уже практически выделены семь главных подгрупп современной таблицы.
Несколько последующих дней Менделеев работал над статьей «Соотношение свойств с атомным весом элементов». В ней ученый обосновывал выбранный им подход: «:…при всей перемене в свойствах простых тел, в свободном их состоянии, нечто остается постоянным, и при переходе элемента в соединения это нечто — материальное и составляет характеристику соединений, заключающих данный элемент. В этом отношении поныне известно только одно числовое данное, это именно атомный вес, свойственный элементу».
Действительно, в то время, когда ученые не имели представления о строении атомов, единственной их характеристикой был атомарный вес. Менделеев не был автором идеи создания системы элементов, основанной на этой величине. До него подобные попытки делали и другие исследователи. Менделеев не старался умалить достижения своих предшественников. Но при этом он в очень корректной форме указывал на прогрессивность своей системы: «Периодическая зависимость свойств несходных элементов и их соединений от атомного веса элементов могла быть установлена после того, как эта зависимость была доказана для сходных элементов. В сопоставлении несходных элементов заключается также, как мне кажется, важнейший признак, которым моя система отличается от систем моих предшественников. Как и эти последние, я принял, за небольшим исключением, те же группы аналогичных элементов, но при этом я поставил себе целью исследовать закономерность во взаимном отношении групп. При этом я пришел к вышеупомянутому общему принципу, который применим ко всем элементам».
Менделеев настаивает на том, что его классификация элементов естественна: «Способ распределения элементов по атомному их весу не противоречит естественному сходству, существующему между элементами, а, напротив того, прямо на него указывает».
В действительности свойства элементов зависят не от веса его атомов, а от их строения, которое, конечно же, в свою очередь связано с этим показателем. Но не имея других характеристик атомов, Менделеев мог отталкиваться только от этой, и такой подход был
действительно самым естественным из возможных.
В конце статьи ученый излагает некоторые положения, вытекающие из открытого им периодического закона:
«1. Элементы, расположенные по величине их атомного веса, представляют явственную периодичность свойств.
2. Сходственные по химическим отправлениям элементы представляют или близкие атомные веса (подобно Pt, Ir, Os), или последовательно и однообразно увеличивающиеся (подобно К, Rb, Cs).
3. Сопоставление элементов или их групп по величине атомного веса соответствует так называемой атомности их и, до некоторой степени, различию химического характера, что видно ясно в ряде Li, Be, С, N, О, F и повторяется в других рядах.
4. Распространеннейшие в природе простые тела имеют малый атомный вес, а все элементы с малым атомным весом характеризуются резкостью свойств. Они по этому суть типические элементы. Водород, как легчайший элемент, по справедливости избирается как самый типический.
5. Величина атомного веса определяет характер элемента, как величина частицы определяет свойства сложного тела.
6. Должно ожидать открытия еще многих неизвестных простых тел, например сходных с AL и Si, с паем 65–75.
7. Величина атомного веса элемента иногда может быть исправлена, зная его аналогии. Так, пай Те должен быть не 128, а 123–126[89].
8. Некоторые аналогии элементов открываются по величине веса и атома».
В конце февраля Менделеев передал рукопись статьи своему коллеге Н. А. Меншуткину. Статья была опубликована в «Журнале Русского химического общества». На заседании Общества доклад по ней сделал, по причине отсутствия автора, Меншуткин. Сам Менделеев был в командировке. По заданию Вольного экономического общества он обследовал несколько сыроварен Тверской губернии. К своей «третьей службе», заботе о развитии промышленности, ученый продолжал относиться не менее серьезно, чем к научной и преподавательской деятельности.
Но открыть периодический закон и, отталкиваясь от него, систематизировать химические элементы было только половиной дела. Следовало еще познакомить научный мир с открытием и убедить ученых в справедливости закона. Летом 1869 года Менделеев участвовал во Втором съезде естествоиспытателей. Он выступил с новым вариантом своей системы. В нем группы элементов со сходными свойствами были расположены уже вертикально, как принято в современном варианте таблицы. Все известные в то время элементы, за исключением семи, нашли в этом варианте свое правильное место. Менделеев продолжал работать над совершенствованием системы. К 1870 году он нашел правильные положения для всех известных элементов.
В 1870–1871 годах ученый издал несколько статей и выступал с докладами по поводу периодического закона. Особое место среди работ Дмитрия Ивановича занимают статьи «Периодическая законность химических элементов» и «Естественная система элементов и применение ее к указанию свойств неоткрытых элементов». О второй из них ученый позже писал: «Это лучший свод моих взглядов и соображений о периодичности элементов и оригинал, по которому писалось потом так много про эту систему. Это причина главная моей научной известности.». В этой работе был впервые коротко сформулирован периодический закон: «.свойства элементов (а следовательно, и образованных из них простых тел) находятся в периодической зависимости от их атомного веса». Современная формулировка отличается только тем, что в ней рассматривается не атомный вес, а заряд атомного ядра.
Менделеев указывал, что открытый им закон может иметь большое значение в дальнейшем развитии химии. Среди возможностей приложения закона ученый называл составление системы элементов, определение свойств еще не открытых элементов и способа их открытия, определение атомного веса малоизученных элементов и исправление этого показателя для целого ряда элементов, пополнение сведений о формах химических соединений. И все эти возможности были реализованы при жизни Менделеева и во многом им самим. Так, к 1871 году он, используя свою периодическую систему, исправил атомный вес многих элементов. Ученый уточнил вес 28 элементов, причем некоторых — кардинальным образом. Например, он показал, что эрбий имеет атомный вес не 56, как считалось ранее, а 170, лантан не 92, а 139, и т. д. Как видим, к 1869 году атомные веса многих элементов были вычислены неверно. Учитывая это обстоятельство и то, что многие элементы тогда вообще не были открыты, можно только удивляться гениальности ученого, который, несмотря на это, смог найти периодическую закономерность.
Еще в первом варианте таблицы Менделеев оставил места для четырех неизвестных элементов с атомными весами 45, 68, 70 и 180. В 1870–1871 годах ученый предсказал химические и физические свойства первых трех из этих элементов и дал им предварительные названия: экабор, экаалюминий и экасилиций. Приставка «эка» означает «следующий за». Этими названиями Менделеев хотел сказать, что предполагаемые элементы должны быть следующими по атомному весу аналогами бора, алюминия и кремния.
В 1875 году француз Лекок де Буабодран открыл новый элемент. Химик назвал его галлием, в честь исторического названия Франции. Реально открытый галлий пришел на смену гипотетическому экаалюминию. В 1879 году шведский химик Нильсон открыл скандий, место которому в системе Менделеева уступил экабор. Экасилиций был заменен в 1886 году германием, который открыл немец Винклер. Справедливость и важность периодического закона блестяще подтвердилась на практике. Но не следует думать, что только после открытия предсказанных Менделеевым элементов периодический закон получил признание. Весной 1871 года ученый отправился в очередную заграничную командировку. Ее целью была закупка необходимых для исследований минералов. В поездке Дмитрий Иванович встречался со многими европейскими учеными, обсуждал с ними периодический закон и свою систему элементов. Выводы Менделеева получили одобрение со стороны многих иностранных коллег. Позже по поводу системы элементов даже возникла полемика о приоритетах. Дело в том, что еще в 1864 году немецкий химик Лотар Мейер создал таблицу из 27 элементов, расположив их в порядке возрастания атомных весов и сгруппировав по валентности. Но теоретических обобщений, подобным периодическому закону Менделеева, немецкий ученый не сделал. Да и полную таблицу всех элементов он создал в 1870 году, то есть уже после выхода «Опыта системы элементов». Однако следует заметить, что некоторые ученые не признавали справедливости закона и многие не понимали и не признавали его фундаментального характера. Для полного признания потребовалось немало времени.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКДанный текст является ознакомительным фрагментом.
Читайте также
Часть третья ВНЕ ЗАКОНА
Часть третья ВНЕ ЗАКОНА Интернет как новая культурная и технологическая среда поставил перед юристами много новых вопросов. Ни у кого не вызывало сомнения, что можно меняться купленными книгами — но как только люди начали меняться файлами, держатели авторских прав
3 «КНИГА ЗАКОНА»
3 «КНИГА ЗАКОНА» Между 1900 и 1903 годами Кроули с размахом путешествовал, потеряв на какое-то время интерес к церемониальной магии, но с головой увлекшись индуистской и буддистской философиями. Его деятельность и интересы на этот период суммируются в меморандуме, написанном
ВНЕ ЗАКОНА
ВНЕ ЗАКОНА Я вышел из ворот, остановился, закуривая. И сейчас же ко мне придвинулись Ноздря и Гога.— Ну, что? Как? — заторопились они, перебивая друг друга, — как приняли?— Нормально, — усмехнулся я, пожимая плечами. — Как положено…— А гроши — отвалили?— Гроши? — Я
«Все — по нормам закона»
«Все — по нормам закона» Я долго не мог понять, почему Мечислав Гриб в тот момент занял худшую из возможных позиций — попытался сделать вид, что ничего страшного не случилось? И неожиданно нашел для себя ответ в одной его реплике, оставшейся в стенограмме той сессии: «У
«Загогулины» основного закона
«Загогулины» основного закона Девятнадцать лет страна живет в нелегитимном конституционном поле30 ноября 2012 г. президент Российской Федерации В. В. Путин встретился с представителями четырех думских фракций: «Единой России», КПРФ, «Справедливой России» и ЛДПР. В ходе
Глава 57. Вся тяжесть закона
Глава 57. Вся тяжесть закона Всем преемникам Энди Гроува на посту генерального директора компании Intel пришлось иметь дело с рядом вызовов в двадцать первом веке, которые сложно было себе представить в двадцатом. Кроме того, им пришлось заполнять пустоту, образовавшуюся
28. С ПРИМЕНЕНИЕМ ЗАКОНА ОТ ПЕРВОГО ДЕКАБРЯ
28. С ПРИМЕНЕНИЕМ ЗАКОНА ОТ ПЕРВОГО ДЕКАБРЯ В Бутырках изоляция от внешнего мира была гораздо более полной, чем в казанских тюрьмах. Камеры комплектовались по принципу — "на одном уровне по ходу следствия". Поэтому к нам совсем не поступали люди с воли. Если и приходили
Бармы закона
Бармы закона Уплотнившееся дыханье капельками опускалось на желтые банные стены. Крошечные черные чашечки, охраняемые запотевшими стаканами железистой крымской воды, были расставлены приманками для красных хоботков караимских и греческих губ. Там, где садились двое,
Глава первая. ВНЕ ЗАКОНА
Глава первая. ВНЕ ЗАКОНА Мне не жить, покуда не верну то, что отнял у меня патрон: маленькое ранчо и жену, стол с нехитрой пищей, мирный сон, дикий вой койота на луну, пашню эту, что со всех сторон тянется к напеву и зерну… Много ль нужно, чтобы быть счастливым: дети и любимая
Орудие закона
Орудие закона В свите Фридриха находился знаменитый болонский правовед Роффред фон Беневент. Именно его следует считать помощником Фридриха в разработке «Капуанских Ассиз», с помощью которых Фридрих расчистил джунгли власти и права, разросшиеся после смерти Генриха VI
Издание закона о евреях
Издание закона о евреях В норманнской Сицилии сравнительно мирно сосуществовали иудеи, магометане, католики и православные христиане. Именно Фридрих II вопреки своей хваленой терпимости разделил сложившееся смешение религий и народов. Он удалил магометан с острова
Явление закона джунглей
Явление закона джунглей А теперь немного медитации Вернемся в 1902 год, когда Кроули в первый раз спустился с непокоренных Гималаев. Он решил навестить старого милого дружка и учителя — Аллана Беннета. Тот окопался в соседнем регионе — на острове Цейлон. К этому времени